分子反應動力學
正文
化學動力學的一個分支,是研究化學反應基元過程分子機理的學科。它用理論物理的方法計算處於某一量子態的分子進行單次碰撞並發生化學反應的幾率(或截面)和產物分子的量子態、空間分布及反應速率常數等。這些研究提供了如何控制和利用化學反應的理論依據。例如,為了使吸能反應I+HCl─→HI+Cl
能夠發生,增加 HCl的振動能比增加其平動能更為有效。它的逆反應Cl+HI─→HCl+I
是一個放能反應,分子反應動力學能夠提供產物分子HCl振動態“布居反轉”的信息,從而為尋找化學雷射工作物質提供了依據。它還能提供反應體系“碰撞對”真實碰撞過程的信息──“碰撞對”是直接反應還是經過一個絡合物的反應。理論計算方法 20世紀30年代,以美國物理化學家H.艾林為代表的學派,用海特勒-倫敦計算H2的方法建立了H+H2反應體系的第一個勢能面,藉助統計力學方法計算了在該勢能面上的熱平衡反應速率常數,稱為絕對反應速率理論或過渡態理論。
分子反應動力學的理論計算方法分為三部分:①化學反應體系勢能面的量子化學計算;②反應截面(或幾率)的計算;③由反應截面計算反應速率常數。因此,也可以說分子反應動力學是研究反應體系在熱能面上運動過程的學科。在確定的勢能面上求解核的運動方程,既可以用經典力學方法,也可以用量子力學方法。
理論 嚴格的理論是量子力學散射理論。分子反應過程的全部信息包含在波函式中,在給定能量下,求解滿足一定漸近條件的薛丁格方程得到波函式,藉助入射波和出射波的幾率流密度守恆的關係,就可以得到反應截面(或幾率)。
以A+BC─→AB+C雙分子共線交換反應為例 (共線反應是指反應體系的三個原子沿直線相互接近的反應),該反應體系的坐標系見圖1。
 分子反應動力學
分子反應動力學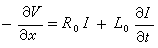
核運動的薛丁格方程為:
Hψ=Eψ (3)
漸近條件為: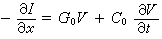
 為雙原子分子的內態波函式;
為雙原子分子的內態波函式; 稱為散射幅。能量守恆條件要求:
稱為散射幅。能量守恆條件要求:  (5)
(5)

H+H2(n)─→H2+H共線交換反應幾率的數值計算結果見圖2。
 分子反應動力學
分子反應動力學 ,一般是在自然反應坐標中用數值求解耦合微分方程。這是一項十分複雜的計算工作。
,一般是在自然反應坐標中用數值求解耦合微分方程。這是一項十分複雜的計算工作。 當反應體系的質量較大,德布羅意波長很短時,用經典軌跡法或者用準經典軌跡法,即對反應物初態分布和產物終態分布作量子校正的經典軌跡法研究反應體系沿勢能面的運動,往往也能得到比較滿意的定性或半定量的結果。
展望 由於分子反應動力學的深入發展,對分子反應散射的研究引起了人們極大的興趣。一方面,分子化學反應的實驗研究為化學反應機理的研究提供了詳細的信息;另一方面,對反應散射的理論計算,既可以同實驗結果互相對比,又可以給予實驗結果以清楚的物理解釋。例如,對F+H2反應體系的實驗和理論研究,發現了產物分子振動態“布居反轉”現象,導致了化學雷射器的產生,從而推動了態-態反應速率的研究,使分子化學反應動力學發展到態-態分子反應動力學的新階段。
參考書目
R. D. Levine and R. B. Bernstein,Molecular Reaction Dynamics,Oxford Univ.Press,Oxford,1974.

