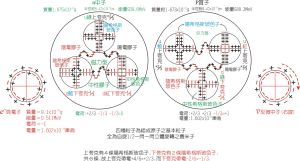
 原子核(含中子,質子)及電子-內部結構模型圖
原子核(含中子,質子)及電子-內部結構模型圖根據原子軌道能級的相對高低,可劃分為若干個電子層,K、L、M、N、O、P、Q….同一電子層又可以劃分為若干個電子亞層,如s、p、d、f等。每個電子亞層包含若干個原子軌道。
在同一電子層中,電子的能量還稍有差異,電子云的形狀也不相同。因此電子層還可分成一個或n個電子亞層。
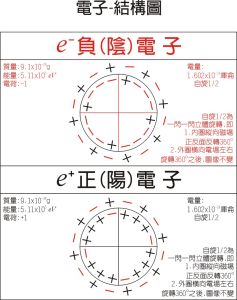 電子-模型圖
電子-模型圖 通過對許多元素的電離能的進一步分析,人們發現,在同一電子層中的電子能量也不完全相同,仍可進一步分為若干個電子組。這一點在研究元素的原子光譜中得到了證實。
電子亞層分別用s、p、d、f等符號表示。不同亞層的電子云形狀不同。s亞層的電子云是以原子核為中心的球形,p亞層的電子云是紡錘形,d亞層為花瓣形,f亞層的電子云形狀比較複雜。
原子軌道的能級可以通過光譜實驗確定,也可以套用薛丁格方程求得。原子軌道的能級與其所在電子的電子層及電子亞層有關, 還與原子序數有關。
E1s<E2s<E2p<E3s<E3p<E3d<E4s<E4d<E4p<E5s<E5p<E6s<E4f<E5d
規則E:np>(n-1)d>(n-2)f>ns
1、不同電子層能級相對高低K<L<M<N…
2、同一電子層不同亞層:ns<np<nd<nf…
3、同一亞層內各原子軌道能級相同,稱為簡併軌道。
4、原子軌道能級隨原子序數增大而降低。
電子軌道亞層在周期表上也有,就是那個s、p、d、f、g等就是亞層排布。
s亞層最多容納兩個電子,p層最多6個,d層、f層依次為10個、14個。
另外在分析時候還要考慮能級交錯。
舉個例子,鐵的亞層在書上標的是3d6 4s2,這就是說,鐵的第四層只用到s層,有兩個電子,而第三層用到D層,D層有六個,這說明第三層的S、P層都飽和,所以S層有2個,P層有6個,D層有6個(上面分析的)所以鐵的第三層有2+6+6=14個電子。
